 A nukleoszómális szerkezet általánosan gátló hatású a transzkripció, a replikáció, valamint a DNS hibajavítás szempontjából. Az eukarióta sejtek ezt a gátló hatást bizonyos nukleoszómák destabilizációjával, vagy mobilizációjával oldják fel, melyen keresztül, ezen folyamatok szabályozása is lehetővé válik. A nukleoszóma stabilitás tehát egy rendkívül fontos szabályozó tényező, melyet feltehetően a hisztonok poszt-transzlációs módosításai (PTM), a hozzájuk kötődő „reader” fehérjék, valamint a nukleoszómák hiszton variáns összetétele is befolyásol. Ebben az összefüggésben a fent említett folyamatok aktivációja során a nukleoszómák destabilizációja várható, míg a nukleoszóma stabilizáció represszív jelleggel bír. Ebbe a logikába illeszkednek azok a megfigyelések is, melyek szerint a H2A.Z variáns jelenléte a nukleoszómákban növelheti, vagy csökkentheti a nukleoszóma stabilitását.
A nukleoszómális szerkezet általánosan gátló hatású a transzkripció, a replikáció, valamint a DNS hibajavítás szempontjából. Az eukarióta sejtek ezt a gátló hatást bizonyos nukleoszómák destabilizációjával, vagy mobilizációjával oldják fel, melyen keresztül, ezen folyamatok szabályozása is lehetővé válik. A nukleoszóma stabilitás tehát egy rendkívül fontos szabályozó tényező, melyet feltehetően a hisztonok poszt-transzlációs módosításai (PTM), a hozzájuk kötődő „reader” fehérjék, valamint a nukleoszómák hiszton variáns összetétele is befolyásol. Ebben az összefüggésben a fent említett folyamatok aktivációja során a nukleoszómák destabilizációja várható, míg a nukleoszóma stabilizáció represszív jelleggel bír. Ebbe a logikába illeszkednek azok a megfigyelések is, melyek szerint a H2A.Z variáns jelenléte a nukleoszómákban növelheti, vagy csökkentheti a nukleoszóma stabilitását.
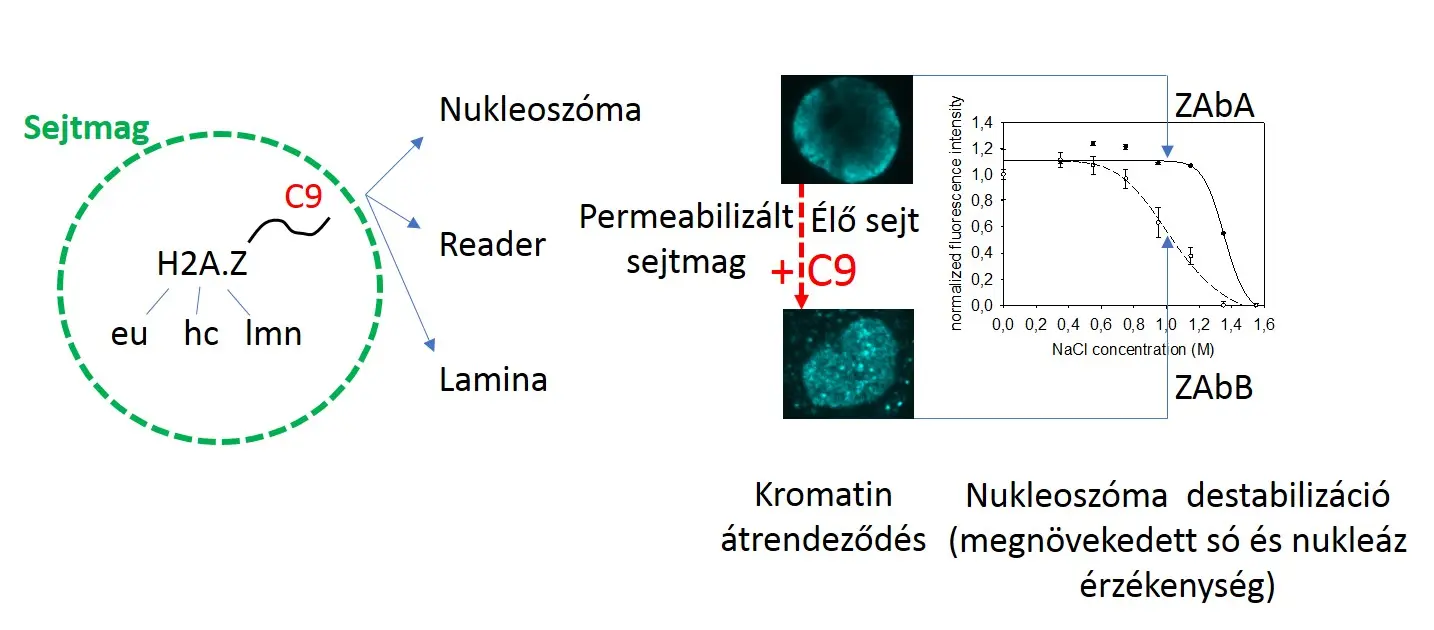
Cikkünkben, egy korábban általunk kidolgozott in situ módszert (Imre L, et al. Nucleosome stability measured in situ by automated quantitative imaging. Scientific reports 7, 12734 (2017)) alkalmaztunk, hogy meghatározzuk, milyen faktorok szabályozzák a H2A.Z tartalmú nukleoszómák stabilitását. Ennek során agarózba ágyazott permeabilizált sejtmagokat kezeltünk növekvő ionerősségű sókoncentráció sorral, majd a sejtmagokban maradt nukleoszómák mennyiségét hiszton PTM-ekre, vagy hiszton variánsokra specifikus antitestekkel történő immunofluoreszcens jelölést követően, automatizált kvantitatív képalkotó citometriával analizáltuk. Módszerünk segítségével heterogenitást figyeltünk meg a H2A.Z tartalmú nukleoszómák között, ami független a nukleoszómák izotípus összetételétől. A H2A.Z tartalmú nukleoszómáknak három típusát különböztettük meg: eukromatikus (H2A.Zeu), heterokromatikus (H2A.Zhc), valamint lamina asszociált (H2A.Zlmn).
Az elsődleges megfigyelésünk az volt, hogy a H2A.Z hisztonok nagy része só hatására a H3 hisztonokkal együtt disszociált a kromatinról, ami a stabilabb szerkezetű heterokromatikus nukleoszómákra (H2A.Zhc) volt jellemző, ellentétben a sokkal kevésbé stabilan kötött H2A.Zeu, H2A vagy H2B hiszton fehérjékkel. Ezen túlmenően a nukleoszómák stabilitása függetlennek bizonyult a H2A.Z1 vagy H2A.Z2 izotípus összetételtől, a hiszton PTM-ektől, valamint a H2A.Z specifikus „reader” fehérjétől, a PWWP2A-tól. Meglepő módon a heterokromatikus H2A.Z nukleoszómákra jellemző stabil szerkezet a H2A.Z C-terminális végének meglététől, vagy hiányától függött. Kísérleteinket a H2A.Z különböző izotípusait, vagy mutáns formáit kifejező sejtvonalak felhasználásával végeztük, illetve a sejtmagban megfigyelt ionerősség-függő nukleoszóma stabilitást in vitro létrehozott, nukleoszómák sorozatából álló, un. nukleoszóma array-en is megerősítettük. A H2A.Z hisztonok C-terminális végi utolsó 9 aminosavat átfedő szekvenciájának deléciója, vagy ezzel a szekvenciával megegyező szintetikus peptiddel történő kezelés (az endogén peptiddel történő kompetíció) a kanonikus H2A-ra jellemző stabilitást idézett elő a H2A.Z nukleoszómák nagy részén, illetve a heterokromatikus, perifériás sejtmagi elrendeződést diffúzzá változtatta. A C-terminális deléciójának, vagy a peptid (C9) kezelés hatására a H2A.Z nukleoszómákon kívül, a konstitutív heterokromatinra jellemző H3K9me3 tartalmú nukleoszómák, illetve a DNS sejtmagi elrendeződése is megváltozott. A kromatin globális átrendeződése a sófüggő nukleoszóma stabilitás változásán kívül, a megnövekedett endonukleáz (nickase, MNase) érzékenységen keresztül is kimutatható volt, a H3K4me3 tartalmú eukromatikus, valamint a H3K9me3 tartalmú heterokromatikus régiókban egyaránt. A H2A.Z rövid C-terminális végének kölcsönhatása más fehérjékkel tehát egyaránt meghatározza a nukleoszómák stabilitását, valamint a kromatin hozzáférhetőségét a H2A.Z tartalmú nagy kromatin doménekben.
A szerzők tanulmányukat a Nature Communications folyóiratban közölték.
Imre László, Ifj. Nánási Péter, Ibtissem Benhamza, Enyedi Nóra Kata, Mocsár Gábor, Rosevalentine Bosire, Hegedüs Éva, Erfaneh Firouzi Niaki, Csóti Ágota, Darula Zsuzsanna, Csősz Éva, Póliska Szilárd, Scholtz Beáta, Mező Gábor, Bacsó Zsolt, H T Marc Timmers, Masayuki Kusakabe, Balázs Margit, Vámosi György, Juan Ausio, Peter Cheung, Tóth Katalin, David Tremethick, Masahiko Harata, Szabó Gábor